01临床研究报告
Q:(上海 注册 华艳):报产的临床研究报告有PI的签字,申请人的盖章,是否可以?
A:(贵州-注册-老张):可以,现在不需要组长单位盖章,申请人盖了就行。
02年报
Q:(浙江-注册-H):年报中是不是公司所有微小变更都要报进去?比如有些涉及到检测仪器的增加,或者储罐的改造这一类性质的变更。
A:(宁波-注册-小月):注册资料里涉及到的信息发生变更需要报,注册资料里会报检测仪器型号,并不会报编号啊,同型号的仪器增加或者减少,没必要报。储罐改造可能是要的,但是具体看对你们产品的影响。变更指导原则好好学习一下,里面提到的都是要报的。没提到的自己评估,自己评估也不确定的就找省局请教。
03生产许可
Q:(文武大人):背景是这样的:一个B证企业委托省外一个生产企业生产某颗粒剂品种,但该生产企业颗粒剂生产线目前还未通过GMP认证,生产许可证中也无相应生产范围,注册申报前的流程是否是这样的:首先让该生产企业申请GMP符合性检查,通过后向所在地省局申请办理受托生产意见函,B证企业办理增项,C证生产企业办理增项,是这样的吗?
A:(广东-药品注册-大明):
1.B证企业和C证生产企业签订质量协议、委托生产合同、三批工艺验证等;
2.B证企业办理生产许可证增项,将拟申报的品种加入生产许可证副本,B证企业申请GMP符合性检查,如果该品种为B证企业首次持有剂型品种,B证省局会对B证企业进行GMP符合性检查,如B证已进行过同剂型其他品种的GMP符合性检查,则可以免检查。
3.C证申请生产范围及该品种的GMP符合性现场检查(有的省局要分开、或B证所在药监发函给C证药监局配合现场检查);
4.C证省局出具(GMP符合性现场检查)办理B证新增(委托);
5.C证新增(受托)。
04通用名核定
Q:(文武大人):一个3类仿制药,国内已有批准临床的,但是没有同品种获批上市,递交申报资料的时候刻了一套通用名称核准的光盘,但是受理通知书上面没有勾选需要核定通用名称,这是真的不需要核定了吗?还是我已经交了相应光盘,所以这里没有勾选?

A1:(沪-打杂-���):没这句话呀,如果想获得多于六个月的过渡期,需要在特别里面写。
A2:(上海-注册-贰雯):

18化药上市许可申报
Q:(clf):化药上市许可申报,光盘资料形式审查受理后,发来的文书里除了受理通知书、注册检验通知书及缴费通知书,有两个档案袋模板,这个档案袋封面模板是用来寄啥资料的?
A:(绿萝):之前是寄纸质资料的,一套原件,一套半复印件,但是现在是电子申报,就不用了。
19I期临床
Q:(随梦而飞):I期试验被否,后期又重新做了,这样再重新递交材料,被否的部分还用提交吗?
A:(千千阙歌):经验之谈:暂时不提交,但是做好CDE审评中索要提交的准备。
20现场核查
Q:(Chloe):仿制药受理后如果有现场核查通知,是怎么通知申请人的?
A:(千千阙歌):会收到短信提醒,或是在CDE核查检验通知书用UKey下载,接到通知后2天左右就可以登录核查中心官网填报。
21IND申报
(Calgary& Valletta):报IND还需递交《化学药品I期临床试验申请药学研究信息汇总表》么?Q:(Calgary& Valletta):报IND还需递交《化学药品I期临床试验申请药学研究信息汇总表》么?
A:最近报的IND项目,没有提交,后面也没要。
22生产许可证
Q:(追梦):新成立的一家药品生产企业,建好了厂房,配备了人员,设备,检验仪器,仓储,建立了管理制度,但是没有品种,没做3批工艺验证,能否申请药品生产许可证A证?
A:(江西—质量注册—危志鹏):可以,可以静态检查,不需要生产,需要有产品工艺规程,产品初定的质量标准文件,关键物料有现场,有设备等等。许可检查是判定符合生产条件的检查。
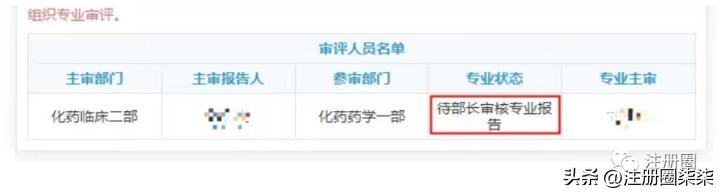
23审评审批
Q:(静听、一季花开):专业审评状态显示待部长审核报告,这个结束后,就到综合审评了吗?
30规格
Q:(注册-秋):参比制剂为溶液剂,规格为A,我司想将规格改为B,用法用量和浓度都一致,是否可行?
A:(注册圈):用法用量和浓度都一致的前提下,各项质量控制指标一致,有充分的依据和理由证明改规格的必要性,可以。
31注册申报
Q:(七安):某公司同步开展了一个品种两个规格的产品研发,部分研究资料共用,在申报时可以每个规格是不同的持有人吗?
A1:(注册圈):理论上可以,实际操作起来比较麻烦。
A2:可以,技术转移给另外一个公司,各报各的规格。
32OTC
Q:(花开半夏-注册-北京):现在符合申报非处方药的品种,必须申报OTC吗?
A:(注册圈):需要报OTC,除非是双跨产品。
声明:本文转载来源于公众号【注册圈】,文章版权归原作者所有,如若了解更多信息可自行前往查看。所有问答均来自于注册圈社群,非官网问答,仅供参考。
相关文章









猜你喜欢